В рамках выставки Pharmtech & Ingredients 2024 прошел круглый стол «Рынок лекарственных препаратов для ветеринарного применения: его особенности, проблемы и перспективы».
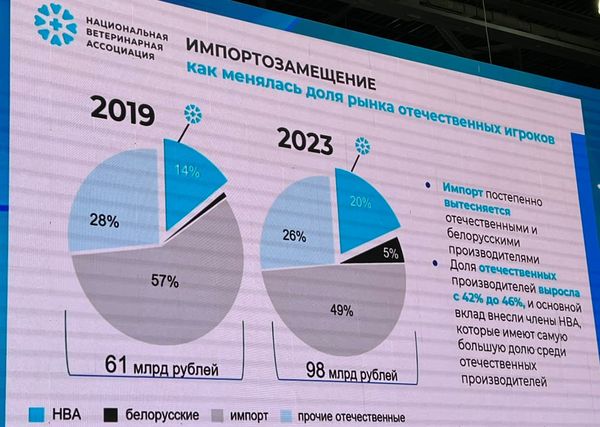
Тимур Чибиляев, исполнительный директор «Национальной ветеринарной ассоциации», привел данные статистики рынка ветпрепаратов в России: Объем препаратов для питомцев – 33,1 млрд рублей (34%), для с/х животных – 64,6 млрд рублей (66%). Препараты иммунобиологические занимают 32,1 млрд рублей (33%) и химико-фармацевтические в форме таблеток – 65,6 млрд рублей (67%).

Ксения Пугачева, начальник отдела нормативно-правового регулирования в сфере обращения лексредств, кормов и кормовых добавок для животных Министерства сельского хозяйства РФ, рассказала о программах поддержки производителей ветпрепаратов.

Пугачева подробно рассказала о подпрограмме «Развитие технологий производства лекарственных препаратов для ветеринарного применения». Она предусматривает разработку научных основ технологии разработки вакцин нового типа для профилактики и лечения болезней животных, способствующих обеспечению защиты здоровья, а также сохранности поголовья и увеличению технологических характеристик с целью импортозамещения.
К задачам подпрограммы были отнесены:
— Обеспечение внутренней потребности в лекарственных препаратах для ветеринарного применения, произведенных по новым (улучшенным) отечественным технологиям
— Создание и внедрение в производство современных отечественных технологий и методов контроля качества лекарственных препаратов для ветеринарного применения
— Формирование современной научно-технической базы разработки и производства отечественных лекарственных препаратов для ветеринарного применения и технологий их производства в рамках обеспечения защиты здоровья животных.
Кроме этого, спикер описала структуру нового национального проекта по обеспечению технологического лидерства «Технологическое обеспечение продовольственной безопасности» и федеральной программы «Ветеринарные препараты». Данный федеральный проект (сейчас он проходит согласование) подразумевает предоставление субсидий для возмещения части затрат вместо грантовой системы:
— Предоставление субсидий вузам и НИИ на обновление материально-технической базы, осуществляющих разработку лекарственных средств для ветеринарного применения (на оснащение лабораторным оборудованием, текущий ремонт)
— Предоставление субсидий производителям лекарственных средств для ветеринарного применения на возмещение затрат на создание и модернизацию объектов инфраструктуры производства
— Льготное инвестиционное кредитование на строительство, реконструкцию, модернизацию и техническое перевооружение предприятий, цехов (объектов), участков, мощностей по производству лекарственных средств для ветеринарного применения (субсидия банкам на возмещение недополученных доходов)


1. Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» в части:
• Оптовой торговли лекарственными средствами (1 01.09.2021 — Решение Совета ЕЭК от 03.11.2016 № 80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза»);
• Регистрационных удостоверений лекарственного препарата — запись в государственном ресстре (с 01.01.2025);
• Полномочий Россельхознадзора по осуществлено регистрации, подтверждения регистрации, внесению изменений и иных связанных процедур с регистрацией.
2. Постановление Правительства РФ от 30.06.2004 № 327 «Об утверждении Положения о Федеральной службе по ветеринарному и фитосанитарному надзору в части:
• Полномочий Россельхознадзора и по осуществлению представления информации о ВЛИ и о процедурах, связанных с регистрацией ВЛП с использованием интегрированной информационной системы,
• Установления формы выписки из государственного реестра лекарственных средств для ветеринарного применения (с 01.01.2025).
Направлены предложения по внесению изменений в:
• Постановление Правительства РФ от 30.06.2004 № 327 «Об утверждении Положения о Федеральной службе по ветеринарному и фитосанитарному надзору» в части:
— выдачи разрешений на проведение клинического исследования иммунологического лекарственного средства, содержащего в своем составе живые патогенные микроорганизмы;
— ведения реестра выданных разрешений на проведение клинических исследований лекарственного препарата.
• статью 333.32.1 части второй Налогового кодекса Российской Федерации в части установления размеров сборов (пошлин) или иных обязательных платежей, предусмотренных Решением Совета Евразийской экономической комиссии от 21.01.2022 № 1.





После спикер продемонстрировал перечень наиболее часто встречающихся несоответствий при инспектировании:
— Не осуществляется мониторинг аэрозольных частиц в чистых зонах классов А,В,С с целью фиксирования изменения уровня контаминации и любых ухудшений в работе системы.
— Не установлен срок хранения одежда для чистых помещений в стерильном состоянии.
— Не организован надлежащим образом контроль целостности и герметичности упаковок после их наполнения.
— Протоколы валидации процесса производства не включают в себя требуемую информацию.
— Не учтена максимальная длительность кампании при проведении валидации очистки.

— При проведении государственных закупок лекарственных средств отсутствует достоверная информация о производстве медицинского изделия полного цикла в Российской Федерации;